Bài viết trình bày về khái niệm “phản ứng thế” là gì trong lĩnh vực hóa học. Đồng thời cung cấp ví dụ và thông tin cụ thể về cách thực hiện phản ứng thế để điều chế khí hidro. Dưới đây là thông tin chi tiết, mời các bạn tham khảo!
Phản ứng thế là gì? Cho ví dụ và bài tập về phản ứng thế
1. Khái niệm “Phản ứng thế” là gì?
“Phản ứng thế” là một trong những khái niệm quan trọng trong hóa học. Phản ứng thế xảy ra khi một nguyên tố trong một hợp chất thay thế nguyên tố khác trong một phản ứng hóa học giữa đơn chất và hợp chất. Trong quá trình này, nguyên tử của đơn chất thay thế nguyên tử của nguyên tố khác trong hợp chất.
Một ví dụ cụ thể để hiểu khái niệm này là phản ứng giữa kẽm và axit clohidric (HCl):
PTPƯ: Zn + 2 HCl → ZnCl₂ + H₂
Trong phản ứng trên, chúng ta có đơn chất là kẽm (Zn) phản ứng với hợp chất là axit clohidric (HCl). Sau phản ứng, nguyên tử của kẽm đã thay thế nguyên tử hydro (H) trong hợp chất HCl.
2. Phân loại phản ứng thế và ví dụ minh họa
2.1. Phản ứng thế trong hóa học vô cơ
Phản ứng thế trong hóa học vô cơ luôn đi kèm với sự thay đổi số oxi hóa của các nguyên tố. Bản chất của phản ứng thế trong hóa vô cơ là một nguyên tố có hoạt động hóa học mạnh hơn sẽ thay thế nguyên tố có hoạt động hóa học yếu hơn trong các hợp chất của nguyên tố này, với điều kiện cụ thể về nhiệt độ và áp suất.
Một phương trình phản ứng thế minh họa cho phản ứng vô cơ có thể là:
Phương trình phản ứng: A + BX → AX + B
2.2. Phản ứng thế trong hóa học hữu cơ
Phản ứng thế trong các hợp chất hữu cơ có thể được chia thành 3 loại chính, bao gồm:
- Phản ứng thế ái lực điện tử.
- Phản ứng thế ái lực hạt nhân.
- Phản ứng thế gốc.
Đây là dạng phản ứng thường gặp trong hydrocacbon no. Để khơi mào phản ứng, chúng ta cần phải chiếu sáng hoặc thêm các chất dễ phân hủy thành gốc tự do hoạt động.
Ví dụ về phản ứng thế trong hóa học hữu cơ liên quan đến hydrocacbon alkan:
PTHH: C2H4 + H2 → C2H6
Etan là một hydrocacbon bão hòa có công thức phân tử là C2H6. Trong khi etylen là một hydrocacbon không bão hòa có công thức phân tử là C2H4. Etylen (C2H4) thay thế một liên kết pi (liên kết đôi) trong etan (C2H6) để tạo thành etan mới (C2H6). Điều này xảy ra bằng cách thêm một phân tử hydro (H2) vào etylen. Trong đó một nguyên tử hydro thay thế một nguyên tử hydro trong etylen, tạo ra etan.
3. Điều chế Hidro phản ứng thế
3.1. Điều chế Hidro trong phòng thí nghiệm
Trong phòng thí nghiệm, khí hidro có thể được điều chế bằng cách cho axit clohidric (HCl) hoặc axit sulfuric loãng (H₂SO₄) tác dụng với kim loại kẽm (Zn). Quá trình này có thể được mô tả như sau:
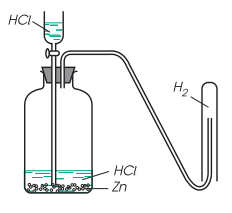
Hình ảnh minh họa về điều chế khí Hidro trong PTN
- Bước 1: Cho một mảnh kẽm hoặc 2-3 hạt kẽm (Zn) vào ống nghiệm.
- Bước 2: Rót 2-3 ml dung dịch axit clohidric (HCl) vào ống nghiệm đó.
- Bước 3: Tiến hành đậy ống nghiệm lại bằng một nút cao su có ống dẫn khí xuyên qua.
- Bước 4: Sau khi khử độ tinh khiết, đảm bảo dòng khí hidro không có lẫn khí oxi. Đưa que đom đóm còn tàn đỏ vào đầu ống dẫn khí và thấy que đom đóm cháy.
- Bước 5: Nhỏ tiếp một giọt dung dịch trong ống nghiệm lên mặt kính đồng hồ và đem cô cạn quan sát hiện tượng.
Hiện tượng quan sát được: xuất hiện các bọt khí trên bề mặt mảnh kẽm rồi thoát ra khỏi chất lỏng, sau đó mảnh kẽm tan dần. Que đom đom còn tàn đỏ được đưa vào đầu ống dẫn khí, khí thoát ra không làm cho than hồng bùng cháy nữa. Khí hidro được đánh lửa và tạo một ngọn lửa màu xanh nhạt. Sau cùng, tiến hành cô cạn một giọt dung dịch, ta sẽ thu được kẽm clorua (ZnCl₂).
Phương trình hóa học điều chế hidro trong phòng thí nghiệm: Zn + 2 HCl → ZnCl₂ + H₂
Lưu ý: Có thể thay thế axit HCl bằng axit H₂SO₄ loãng; kim loại Zn có thể được thay thế bằng Fe hoặc Al.
3.2. Điều chế Hidro trong công nghiệp
Trong công nghiệp, khí hidro (H₂) có thể được điều chế bằng 3 phương pháp chính:
- Điện phân nước.
- Sử dụng than để khử oxi từ nước (H₂O) trong lò khí than.
- Điều chế H₂ từ khí tự nhiên hoặc khí dầu mỏ.
4. Bài tập ví dụ về phản ứng thế
Những bài tập ví dụ về phản ứng thế sau đây giúp học sinh ôn tập và kiểm tra kiến thức. Các bài tập này liên quan đến cách điều chế hidro và tính toán lượng kim loại cần dùng.
Bài 1: Những phản ứng hóa học nào dưới đây có thể được sử dụng để điều chế hidro trong phòng thí nghiệm?
- (1) Zn + H₂SO₄ → ZnSO₄ + H₂
- (2) 2 H₂O → 2 H₂ + O₂
- (3) 2 Al + 6 HCl → 2 AlCl₃ + 3 H₂
Đáp án: Phản ứng 1 và phản ứng 3 có thể được sử dụng để điều chế hidro trong phòng thí nghiệm.
Bài 2: Trong phòng thí nghiệm hóa học có các kim loại kẽm và sắt, dung dịch HCl và axit H₂SO₄.
a) Viết các phương trình hóa học có thể được sử dụng để điều chế hidro;
b) Phải dùng bao nhiêu gam kẽm, bao nhiêu gam sắt để điều chế được 2.24 lít khí hidro (đktc)?
Đáp án:
a) Viết phương trình hóa học có thể sử dụng để điều chế hidro:
- Zn + 2 HCl → ZnCl₂ + H₂
- Fe + 2 H₂SO₄ → FeSO₄ + 2 H₂
b) Tính khối lượng gam kẽm (Zn) và gam sắt (Fe):
- Vì 2.24 lít hidro ở đktc tương đương với 0.1 mol H₂.
- Khối lượng kẽm cần dùng mZn = 65×0,1 = 6,5g.
- Khối lượng sắt cần dùng mFe = 56×0,1 = 5,6g.
5. Lời kết
Các bạn vừa được giới thiệu về khái niệm “phản ứng thế” là gì trong hóa học. Đồng thời bài viết còn cung cấp ví dụ về phản ứng thế và cách điều chế hidro trong phòng thí nghiệm cũng như trong công nghiệp. Mình còn chia sẻ bài tập thực hành để giúp các bạn học sinh ôn tập kiến thức về chủ đề này. Hy vọng rằng bản viết này đã giúp bạn hiểu rõ hơn về phản ứng thế và cách điều chế hidro.










![Tất cả các Công Thức Đạo Hàm đầy đủ nhất [Full]](https://hoconlinemienphi.com/wp-content/uploads/2025/03/cong-thuc-dao-ham-120x86.jpg)



![Bài thuyết trình về Năng lượng Tái tạo [Dàn ý + Văn mẫu]](https://hoconlinemienphi.com/wp-content/uploads/2025/04/thuyet-trinh-ve-nang-luong-tai-tao-120x86.jpg)

