Phản ứng CuO + HCl suy ra CuCl2 + H2O là phản ứng trao đổi rất dễ cân bằng. Cách thực hiện, phương trình phản ứng CuO + HCl và các bài tập liên quan sẽ được chia sẻ bên dưới đây.
1. Tìm hiểu về phản ứng CuO + HCl
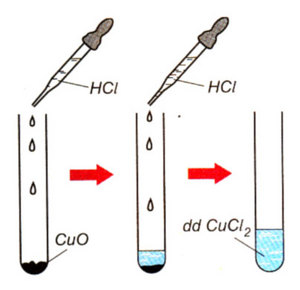
Cách thực hiện phản ứng trong PTN: nhỏ từ từ dung dịch axit clohidrit (HCl) vào ống nghiệm có chứa chất rắn đồng II oxit (CuO).
Hiện tượng: Chất rắn đồng II oxit (CuO) tan dần trong dung dịch axit clohidrit (HCl). Dung dịch mới được tạo thành có màu xanh lam, đó là đồng II điclorua (CuCl2).
Phương trình hóa học tổng quát:
CuO + 2HCl → CuCl2 + H2O
Phương trình iron thu gọn của CuO + HCl:
CuO+2H+ → Cu2++H2O
2. Bài tập liên quan đến phản ứng CuO + HCl
- Bài tập 1: Viết phương trình phản ứng hoá học giữa CuO và HCl, sau đó xác định sản phẩm của phản ứng.
Lời giải: Phương trình phản ứng: CuO + 2 HCl -> CuCl2 + H2O
- Bài tập 2: Cho 10 gram CuO và 50 ml axit HCl 0.1 M. Hãy tính lượng sản phẩm CuCl2 mà bạn có thể thu được sau phản ứng.
Lời giải:
Đầu tiên, tính số mol CuO:
Số mol CuO = Khối lượng / khối lượng phân tử = 10 g / 80 g/mol = 0.125 mol
Sau đó, tính số mol HCl trong 50 ml (0.05 l) axit 0.1 M:
Số mol HCl = Nồng độ x thể tích = 0.1 mol/l x 0.05 l = 0.005 mol
Theo phương trình phản ứng, 1 mol CuO cần 2 mol HCl và số mol CuCl2 hình thành sẽ bằng số mol HCl đã dùng:
Số mol CuCl2 = 0.005 mol (HCl) / 2 = 0.0025 mol
CuCl2 có khối lượng phân tử 64 g/mol, vì vậy khối lượng CuCl2 là:
Khối lượng CuCl2 = Số mol x khối lượng phân tử = 0.0025 mol x 64 g/mol = 0.16 g
- Bài tập 3: Sản phẩm của phản ứng CuO + HCl là gì?
a) CuCl2 và H2O
b) CuCl và H2O
c) Cu2Cl3 và H2O
d) Cu(OH)2 và HCl
Đáp án 1: a) CuCl2 và H2O
- Bài tập 4: Trong phản ứng CuO + HCl, số mol CuO cần để phản ứng hoàn toàn với 0.3 mol HCl là bao nhiêu?
a) 0.3 mol
b) 0.15 mol
c) 0.6 mol
d) 0.1 mol
Đáp án 3: b) 0.15 mol
- Bài tập 5: Nhỏ từ từ 0.2 mol HCl vào 0.1 mol CuO. Hiện tượng xảy ra là gì? Viết phương trình phản ứng và tính lượng sản phẩm CuCl2 và H2O sau phản ứng.
Lời giải:
Hiện tượng: dung dịch xuất hiện màu xanh lam
PTPU: CuO + 2 HCl -> CuCl2 + H2O
Số mol CuCl2 hình thành là 0.1 mol (vì số mol CuO) x 2 = 0.2 mol.
Số mol H2O hình thành là 0.1 mol (vì số mol CuO).
3. Trả lời câu hỏi CuO + HCl
3.1. CuO + HCl có phản ứng không?
Phản ứng giữa CuO (đồng(II) oxit) và HCl (axit clohiđric) có xảy ra. Đây là một phản ứng giữa oxit bazơ và axit, tạo thành muối đồng(II) clorua (CuCl2) và nước. Không cần nhiệt độ hay xúc tác, phản ứng xảy ra ngay trong dung dịch.
3.2. CuO tác dụng với HCl có hiện tượng gì?
Khi CuO (đồng(II) oxit) tác dụng với dung dịch HCl (axit clohiđric), hiện tượng quan sát được như sau:
Hiện tượng:
- CuO tan dần: CuO là chất rắn màu đen, khi cho vào dung dịch HCl, nó sẽ tan dần.
- Dung dịch chuyển sang màu xanh nhạt: Sau khi CuO tan, dung dịch trở thành màu xanh nhạt đặc trưng của muối CuCl2 (đồng(II) clorua) hòa tan trong nước.
Giải thích hiện tượng:
- Quá trình tan: Do CuO phản ứng với axit HCl, tạo ra muối CuCl2 tan trong nước và nước (H2O).
- Màu sắc: Màu xanh nhạt của dung dịch là do ion Cu2+ từ muối CuCl2
Hiện tượng này thường được dùng để kiểm tra tính chất hóa học của oxit bazơ khi gặp axit.
3.3. CuO + HCl ra màu gì?
- Ban đầu: là chất rắn màu đen.
- Sau phản ứng: tan dần và dung dịch chuyển sang màu xanh nhạt.
3.4. CuO + HCl cân bằng
Phương trình hóa học giữa (đồng(II) oxit) và (axit clohiđric) là:
Cân bằng:
- Ở vế trái: CuO có 1 nguyên tử Cu, 1 nguyên tử O; HCl có 2 nguyên tử H và 2 nguyên tử Cl.
- Ở vế phải: CuCl2 có 1 nguyên tử Cu và 2 nguyên tử Cl; H2O có 2 nguyên tử H và 1 nguyên tử O.
4. Lời kết
Như vậy là các bạn vừa tìm hiểu xong phản ứng CuO + HCl và giải các bài tập cơ bản về phản ứng này. CuO + HCl là phản ứng thế giữa oxit kim loại và axit điển hình. Còn nhiều phản ứng hóa học khác đang chờ bạn tìm hiểu tại website Học Online Miễn Phí nữa đấy.








![Tất cả các Công Thức Đạo Hàm đầy đủ nhất [Full]](https://hoconlinemienphi.com/wp-content/uploads/2025/03/cong-thuc-dao-ham-120x86.jpg)






